哈工大全媒体(梁英爽 李月/文 李月/图)近日,哈工大生命科学和医学学部、哈工大郑州研究院贺强、吴英杰教授团队在心肌损伤精准治疗领域取得重要进展。团队从自然界旋转分子马达驱动的细菌汲取灵感,研发出光合磷酸化纳米机器人(Photophosphorylation Nanobot),通过旋转生物分子马达ATP合酶的能量转化过程,实现光驱动的可编程运动,在动物活体模型中实现了主动迁移至心肌损伤区域,显著提升胞内ATP水平,有效重建了局部代谢功能。研究成果以《主动靶向修复心肌损伤合成代谢的光合磷酸化纳米机器人》(A Photophosphorylation Nanobot for Restoring Anabolism of MyocardialInjury)为题,发表在《美国化学会志》(Journal of the American ChemicalSociety)上。该自供能、自导航的磷酸化纳米机器人系统为心血管疾病以及其它由能量代谢紊乱引起的相关病症精准治疗提供了新策略。
心肌损伤是诸如心肌梗死、心肌炎、心肌病等心血管疾病导致的心肌细胞受损、甚至坏死的表现。恢复和维持细胞的能量代谢是修复受损心肌细胞功能的关键,也是治疗心血管疾病的重要策略。当前临床采用静脉注射ATP的给药途径,但ATP在体内易分解、易诱发炎症反应、难以进入细胞内部。因此,如何实现ATP的靶向递送或在病灶部位的原位合成已成为心血管疾病精准治疗的技术难题。
针对这一挑战,研究团队运用自然界最小的旋转生物分子马达—ATP合酶作为驱动引擎,构建了一种兼具定向迁移和能量分子ATP供给功能的磷酸化纳米机器人。该纳米机器人基于可控分子自组装原理,运用天然类囊体与卵磷脂囊泡共挤出过程中发生的相分离,促使ATP合酶非对称地嵌入纳米机器人膜表面。这种设计保留了天然类囊体膜的光吸收系统,使纳米机器人能够吸收光能并将其转化为腔内质子势能,从而驱动ATP合酶旋转,触发光合磷酸化反应合成ATP能量分子。同时,磷酸化纳米机器人在光照下表现出显著增强的平动扩散效率,最高增幅达89%。在梯度光场的作用下,磷酸化纳米机器人展现出类细菌的自适应性趋光行为,具备高度可编程性与靶向性。
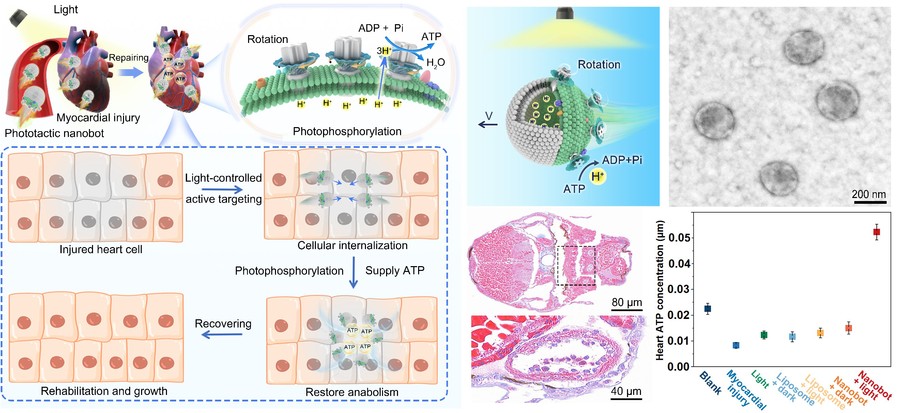
磷酸化纳米机器人主动靶向修复损伤心肌细胞能量和合成代谢过程
哈工大生命科学和医学学部、哈工大郑州研究院与中国科学院化学研究所为论文共同通讯单位。贺强教授、吴英杰教授,中国科学院化学研究所李峻柏研究员为论文共同通讯作者。生命科学和医学学部博士研究生李月为论文第一作者,博士研究生陈莹和国科温州研究院玄明君研究员参与相关研究工作。
该研究获国家自然科学基金重大项目、黑龙江省重点研发计划等项目支持。


